Al indagar sobre lo que es la ingeniería genética es muy fácil caer en el error de pensar que esta únicamente persigue la manipulación del ADN para fabricar transgénicos en masa que, si bien se ha evidenciado en algunas empresas con políticas poco éticas, lo cierto es que las técnicas de ingeniería genética que surgen de la tecnología biológica moderna pueden hacer mucho más que eso.
Índice de contenido
ToggleAmplificación del ADN o Reacción en cadena de la polimerasa (PCR)
La ampliación de ADN es un método o técnica dentro de la biotecnología e ingeniería genética que permite a los especialistas crear miles de millones de copias de un fragmento específico de ADN. Este método puede ejecutarse incluso cuando la muestra tiene porciones diminutas de material genético.
Este proceso de multiplicación o desarrollo de copias de ADN se conoce como ampliación y se lleva a cabo gracias a la reacción en cadena de la polimerasa.
Gracias a esta reacción es posible estudiar a profundidad muestras muy pequeñas de ADN en un laboratorio.

¿Por qué el estadounidense Kary Banks Mullis ganó el Premio Nobel en 1983?
El estadounidense Kary Banks Mullis ganó el Premio Nobel de Química en 1983 porque fue quien descubrió y desarrolló los estudios que derivaron en el descubrimiento del PCR.
Sub-procedimientos
Básicamente, consiste en calentar la muestra de ADN a temperaturas muy altas (más de 90°) lo que provoca que las conexiones que mantienen unidas a las dos cadenas que conforman al material genético se rompan (desnaturalización).
En este punto se bajan las temperaturas, lo que provoca que los cebadores, fragmentos cortos de ADN compatible con la cadena origina, se fusionen con sus cadenas molde complementarias (las cadenas sueltas resultantes de proceso anterior).
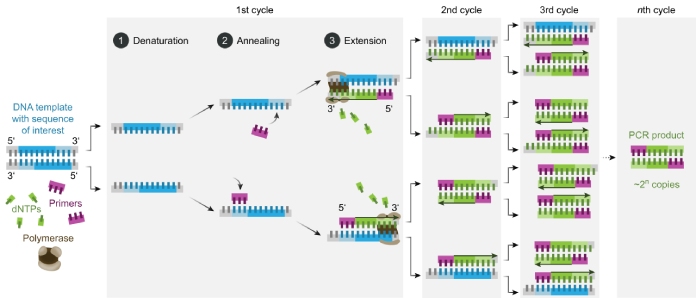
Ahora se tienen dos cadenas parciales. Al subir la temperatura nuevamente, el ADN Polimerasa se incorporará a las cadenas incompletas, sintetizando en muy poco tiempo una muestra idéntica al ADN original.
El ciclo se repite múltiples veces y en pocos minutos se han podido hacer miles de copias de una misma muestra de material genético.
Herramientas
Para hacer una PCR se requiere:
- Material de Buffer con magnesio.
- Mezcla en partes iguales de los 4 dNTPs.
- Los cebadores compatibles con la muestra.
- La Taq Polimeraza.
- Muestra de ADN
Aplicaciones
Los PRC han difundido la importancia de la ingeniería en la medicina, debido a que se aplican para una gran cantidad de procedimientos. Principalmente, destaca su función como mecanismo primario de multiplicación de secuencias de ADN específicas como, por ejemplo, aquellas que tienen los factores deseados que se quieren estudiar o implantar en procedimientos posteriores.

¿Por qué se consideran tan importantes las PCR en la biomedicina de producción?
Se consideran tan importantes las PCR en la biomedicina de producción porque permiten tomar muestras muy pequeñas de material genético y replicarlo en solo minutos a miles de millones de copias para poder hacer estudios completos, lo que facilita la detección de enfermedades, entre muchas otras cosas.
Otras aplicaciones de clave de esta técnica son:
- Realización de pruebas de paternidad.
- Estudio del genoma para detectar cáncer y otras enfermedades genéticas.
- Identificación de huellas genéticas a partir de muestras pequeñas (famosas en la ciencia forense).
- Detección de enfermedades infecciosas.
La más importante de las técnicas de ingeniería genética: limitaciones y e implicaciones éticas
Las técnicas de amplificación del ADN, a pesar de no tener limitaciones claras en la cantidad de material que es capaz de duplicar, tiene grandes dificultades de control ambiental y variables de temperaturas muy sensibles que pueden llevar a errores importantes en su función como herramienta de diagnóstico.
Por otro lado, su utilización permite realizar procedimientos complejos sin la necesidad de requerir células vivas.
Si bien la clonación de material humano sin consentimiento es un punto de interés en lo que se refiere a las implicaciones éticas, se puede decir que sus aplicaciones bien implementadas han sido muy beneficiosas a nivel médico. Por ejemplo, en la detección y el estudio de virus como el COVID-19.
Secuenciación del ADN
Toda la información que se guarda dentro del ADN se almacena en forma de código. Dicho código no es más que una secuencia (orden específico) de cuatro moléculas, llamadas bases (Identificadas en genómica con las letras A, T, C y Q).
Mediante la secuenciación del ADN, los especialistas saben qué clase de información lleva un gen en específico y pueden deducir a través de él – gracias a años de estudio y desarrollo de este campo del conocimiento – múltiples características, comportamientos y patrones del genoma humano.
En otras palabras, esta técnica consiste en registrar y decodificar el lenguaje en el que está programada una forma de vida.
Sub-Procedimiento
La secuenciación de ADN puede darse de múltiples formas. Usualmente, se lleva a cabo mediante la segmentación de una molécula de ADN para su posterior multiplicación a través de ampliación o PCR.
Una vez que se tiene material genético suficiente, se utilizan moléculas de restricción distintas en los trozos de ADN clonado para producir varios fragmentos únicos y más pequeños de ADN, mucho más fáciles de secuenciar.
Una vez que se ha registrado el orden de las moléculas en los diferentes fragmentos, se comparan unos con otros, descartando a los que están repetidos.
Dando un ejemplo muy simplificado, el ADN se rompe en pedazos, se contabilizan las piezas y estos pedazos se vuelven a unir como si se tratara de un rompecabezas. De esta manera se puede conocer toda la secuencia de un gen aislado.
Herramientas
En la actualidad este procedimiento está completamente automatizado. Los equipos que se apoyan en inteligencia artificial pueden realizar por su cuenta las mezclas químicas necesarias y con ayuda de moléculas “marcadoras” con fluorescencia, pueden hacer uso de un láser para detectar el orden de los nucleótidos y guardar el código.
En pocas palabras, registran la secuencia y la almacenan en una base de datos.


¿Por qué se utilizan ordenadores e inteligencia artificial en la secuenciación?
Se utilizan ordenadores e inteligencia artificial en la secuenciación porque el volumen de información a registrar es un genoma es enorme. Gracias a ellos ha sido posible comparar cantidades ingentes de códigos entre organismos, así como mapear y secuenciar los códigos genéticos de muchas especies, entre ellas, las del ser humano.
Aplicaciones
Si se sabe cómo deben ser las secuencias correctas de un gen en específico, se pueden detectar mutaciones en el ADN.
La secuenciación de ADN permite detectar tendencias anómalas que sugieran la propensión de padecer determinadas enfermedades. En aspectos más amplios, han ayudado a conocer el funcionamiento de determinadas cadenas.
Gracias a esta técnica, los especialistas pueden seleccionar genes que manifiestan ciertas características favorables para aislarlos e implantarlos en otros organismos.
Limitaciones e implicaciones éticas del procedimiento
La secuenciación de ADN está lejos de ser una técnica económica para usar a nivel individual en los seres humanos.
Por otro lado, los equipos necesarios para la realización de estas pruebas requieren de una amplia inversión. Sin mencionar que la implicación de la fluorescencia puede derivar en picos de detección anormales y un amplio etcétera.
En lo que respecta a las implicaciones éticas, es importante entender el impacto emocional que determinados resultados pueden desencadenar en los pacientes o terceros sometidos a estas pruebas. En algunos países, los estudios genéticos sin consentimiento conllevan a responsabilidades legales.
Manipulación del ADN a través de ADN recombinante y Clonación molecular
El ADN recombinante y la clonación molecular son dos técnicas de manipulación del ADN que van de la mano y tienen como objetivo modificar el ADN de una o más especies para influir en sus características. Estos procedimientos se dan mediante el aislamiento de un fragmento específico de un gen.
Estos fragmentos específicos pueden implantarse (mezclarse) con fragmentos complementarios de otras especies y crear genes nuevos, eliminarse para remover características puntuales en un espécimen o introducirse en otras especies para crear productos transgénicos o especies genéticamente modificadas.
Esta técnica trasciende la definición de manipulación de un gen simple, ya que algunos ADN recombinantes pueden ser productos de quimeras genéticas de varias especies.

¿Por qué se le llama “recombinante” a la técnica de ingeniería genética?
Se le llama “recombinante” a la técnica de ingeniería genética porque su práctica requiere la mezcla de material genético de dos o más organismos de distinta especie.
Sub-procedimientos
El procedimiento para originar un ADN recombinante parte en la secuenciación y detección de un gen de interés.
Una vez que se identifica el fragmento que se quiere transmitir a otra especie, este se corta a través de las ya conocidas encimas de restricción, que son capaces de detectar secuencias específicas de ADN y “cortarlas” en dos extremos para extraerlos de las secuencias. Algo parecido a “tijeras biológicas”.
Ahora se elige un vector, es decir, una célula que servirá de vehículo para transmitir la modificación. Este vector recibirá un corte mediante la misma enzima de restricción, dejando un espacio perfecto (complementario) para la inserción del gen deseado.
Mediante un procedimiento que involucra a las enzimas ADN ligasas y variaciones de temperatura, se incorpora el nuevo gen con las características deseadas en el vector. De esta manera se crea un ADN recombinante.
El vector transferirá el ADN recombinante a las células que se desean modificar y estas, bajo un proceso de selección y cultivo, se reproducirán mostrando nuevas características, resultado de procesar y decodificar el gen externo.
Herramientas para la manipulación del ADN
Un sinfín de herramientas pueden hacer parte de los procesos de desarrollo de ADN quimérico o recombinante y de los procesos de cultivo o clonación de células con características únicas. Entre ellas se encuentran:
- Los materiales de laboratorio para el cultivo de bacterias vectores.
- Las enzimas involucradas en el procedimiento de corte y ligadura de fragmentos de ADN (nucleasas, polimerasas, ligasas…).
- Los entornos de cultivo para la selección por distintos métodos de las células huéspedes del ADN recombinante.
- Herramientas de análisis celular para la detección de características deseables.
- Fragmentos de ADN a transferir.
- Otros.
Aplicaciones
El ADN recombinante es la base fundamental en la producción de transgénicos, es decir, elementos como plantas, frutas, granos, bacterias, células puntuales e incluso animales con características ajenas a su condición natural, implantadas mediante modificación genética.
En la industria alimenticia, por ejemplo, especies transgénicas pueden producir frutos con mayor volumen vitamínico, granos más nutritivos y cultivos abundantes o mejor adaptados a entornos desafiantes.
En los animales, se reconoce la reproducción de especies domésticas que tienen bloqueadas ciertas enzimas conocidas como las principales causas de las alergias en humanos.
El uso de ADN recombinante puede usarse incluso para modificar embriones, con la finalidad de introducir genes que deriven en especies clonadas genéticamente idénticas.

¿Por qué la tecnología del ADN recombinante es útil para la producción de medicamentos?
La tecnología del ADN recombinante es útil para la producción de medicamentos porque gracias a ella se pueden sintetizar compuestos de manera abundante y producir proteínas humanas en otros organismos para aprovecharlos en los tratamientos, como la insulina.
Limitaciones e implicaciones éticas del procedimiento
Está claro que las implicaciones éticas de las técnicas de manipulación genética a través de ADN recombinante son en extremo profundas.
Por un lado, este medio rechaza el concepto de modificación de genes en animales, para casi cualquier fin, siendo interpretado como un acto innecesario que solo busca la vivencia tortuosa de los humanos con otros seres vivos y que extiende el sufrimiento animal.
En lo que respecta a la creación de clones embrionarios, destaca la prohibición expresa de estas prácticas en humano debido a sus complejas raíces filosóficas y sociales. Aunque las legislaturas deberían extender esto a los animales en general.
Profundizando más se encuentran los posibles efectos accidentales impredecibles como la creación de bacterias ultraresistentes a los antibióticos (una posibilidad científicamente comprobada).
Si bien la imaginación da para mucho más, hay que reconocer que existen limitaciones tecnológicas que impiden las aplicaciones más avanzadas de esta técnica. Pero, considerando su potencial, no es de sorprenderse que sea una de las más vigiladas a nivel mundial por la comunidad científica y la que mayor peso regulatorio posee.
Mutación excepcional (Mutagénesis)
La mutación excepcional es un concepto de la ingeniería genética y biotecnología que hace referencia al proceso por el cual se inducen una serie de mutaciones aleatorias en diferentes niveles del genoma de una especie cuyo ADN se encuentre previamente secuenciado.
Lo que se quiere lograr con ello es alterar cadenas específicas de manera aleatoria para evaluar lo que dichas mutaciones causan al traducirse dentro de los organismos.
Gracias a esta técnica, los genetistas son capaces de entender las funciones de determinados genes, descubrir nuevos patrones deseables, registrar cadenas que provocan enfermedades para reconocerlas en el futuro y mejorar su conocimiento sobre el mapa genético de una especie.

¿Por qué se llama mutación excepcional?
Se llama mutación “excepcional” a esta técnica de ingeniería genética porque parte de la producción de mutaciones aleatorias, de las cuales, se filtran o separan únicamente aquellos fragmentos de gen que muestren propiedades nuevas favorables o excepcionales.
Sub-procedimientos: ¿En qué consiste la manipulación de un gen mutado?
Existen muchos sub-procedimientos involucrados dentro de la mutagénesis debido a que esta puede conseguirse a través de múltiples vías. Por ejemplo, se pueden integrar mutágenos para producir errores aleatorios en decenas de miles de copias de la misma cadena para estudiar los efectos en las alteraciones de determinadas secuencias.
También se reconoce la mutagénesis dirigida, que es un método relativamente novedoso por el cual se utiliza oligonucleótidos mutagénicos sintéticos para provocar alteraciones puntuales en un fragmento específico de ADN.
Otra estrategia de mutación excepcional es la aplicación de PCR incorporando ADN polimerasa defectuoso.
Otra forma de conseguirlo es mediante la multiplicación in vivo, que se logra mediante la implantación de genes puntuales en células con sistemas de replicación defectuosos. Al reproducirse, estas aumentan la probabilidad de tener mutaciones “naturales” por error de replicación.
Herramientas
Es difícil poder enumerar las herramientas de una técnica tan amplia en metodologías como la mutación controlada o aleatoria de genes.
En las apreciaciones generales se requieren:
- Equipos tecnológicos para secuenciar el ADN.
- Materiales de laboratorio para la manipulación de enzimas.
- Polimerasas específicas, para la producción de fallos de replicación.
- Termo osciladores y herramientas de biología molecular.
- Mutágenos y reactivos.
- Kits para realizar procedimientos de PCR y ADN recombinante.
Aplicaciones
Tal como se ha mencionado antes, la mutagénesis o mutación excepcional tiene como objetivo medir los efectos de las variaciones no naturales en las secuencias de ADN.
Esta técnica permite registrar nuevos patrones anómalos, explorar características emergentes, diagnosticar afecciones genéticas, diseñar nuevos tratamientos médicos, mejorar la producción de proteínas, generar variantes con mejores características enzimáticas y comprender a mayor profundidad el funcionamiento genético y regulador de las células.
Curiosamente, la mutación excepcional también se puede aplicar de manera controlada en la terapia genética para corregir errores en las cadenas de ADN humano, animal, vegetal y demás.
Consiguiendo la cadena genética adecuada se pueden insertar genes mutados que corrijan las mutaciones malignas en determinadas secuencias. Aunque esto aún se encuentra bajo estudio.
Limitaciones e implicaciones éticas del procedimiento
A pesar del gran número de aplicaciones de esta técnica, resulta ser una de las menos deseadas dentro de la ingeniería genética. Características como la aleatoriedad de las mutaciones resultan difíciles de controlar en casos reales y requieren de arduos trabajos de selección para producir resultados útiles.
Por ejemplo, mediante este método se pueden crear muchas mutaciones benéficas con características potenciadas, pero, se pueden producir mutaciones potencialmente peligrosas o mortales.
Otro escenario problemático se encuentra en la dificultad de detectar a los especímenes con mutaciones benéficas entre una colonia de cultivo. Además, se reconoce la imposibilidad de reproducción de resultados exactos en laboratorio.
Bloqueo génico
El bloqueo genético es una técnica de ingeniería genética ampliamente extendida y consiste en la desactivación o supresión de una característica expresa a través de la modificación de una secuencia de ADN.
Aunque el bloqueo genético busca reprimir ciertos rasgos en un individuo bajo tratamiento celular, el procedimiento suele ser el mismo que se emplea para crear un transgénico mejorado, al que se le suprime una secuencia y se le implanta otra con propiedades más deseables.

¿Por qué se requiere de un estudio minucioso para aplicar bien el bloqueo genético?
Se requiere un estudio minucioso para aplicar el bloqueo genético porque este puede producir cambios puntuales o sistemáticos en un individuo, por lo que es probable encontrar potenciales cambios no advertidos luego de la supresión de un gen.
Sub-procedimientos
Tal como sucede con otras técnicas utilizadas en la ingeniería genetista, el bloqueo puede realizarse mediante la combinación de múltiples metodologías.
Por ejemplo, para hacerlo a través de los métodos de ADN recombinante, se corta con enzimas de restricción el segmento de gen que controla la característica a modificar y se implanta una versión mutada del mismo que anula toda la secuencia.
Otra forma de lograrlo es a través de la transgénesis, con la cual se agregan secuencias modificadas sobre fragmentos de las cadenas originales hasta conseguir las que produzca proteínas defectuosas que resulten en la eliminación de la característica deseada. Algo similar a la aplicación de mutágenos hasta provocar cambios en la secuencia que anulen las características objetivo.
Herramientas
Existen muchas herramientas que se requieren para llevar a cabo las tareas de bloqueo genético, aunque estas varían dependiendo de la metodología a implementar para conseguir las supresiones de características.
Entre las más habituales se encuentran:
- Materiales de laboratorio y enzimas de activación.
- Herramientas de biogenética.
- Muestras de ARN interferente.
- Materiales para PCR.
- Inhibidores de transcripción.
- Polimerasas específicas, para la producción de fallos de replicación.
- Termo osciladores.
Aplicaciones
Usualmente, la técnica de bloqueo genético se utiliza en entornos de investigación, estudio o experimentación genética.
En un campo menos amplio, se puede usar para comprender el funcionamiento de ciertas células e idear tratamientos terapéuticos que apunten a deshabilitar los genes clave que les permite replicarse y sobrevivir.
También se emplea en la industria agrícola para producir plantas transgénicas con mayor resistencia a las plagas, hongos y virus, inhabilitando las cadenas de las que se aprovechan los atacantes.

El silenciamiento genético
Una estrategia derivada del bloqueo genético y con resultados más estables es la del silenciamiento.
Como bien se sabe, los genes tienen la capacidad de transmitir instrucciones bajo las cuales las células crean proteínas que cumplen funciones básicas en el organismo. Mediante los ARN silenciadores, es posible impedir la comunicación de ciertas cadenas, pero sin removerlas o modificar directamente el ADN de un animal u otro ser vivo (sin cortar y pegar genes).
Gracias a moléculas como el miRNA no es necesario arrancar o añadir genes para producir características deseables. Es decir, no se producen nuevos seres transgénicos.
Aunque este medio no está de acuerdo con esta práctica en animales, se reconoce el uso de esta estrategia para crear vacas incapaces de sintetizar la proteína BLG en la leche, por lo que su producto lácteo no produce reacciones alérgicas en humanos.
Si bien casi todos los ejemplos en animales son completamente nefastos, es cierto que esta técnica puede funcionar en otras células, como las vegetales.
Sus implicaciones fueron tales que plantearon una nueva definición de ingeniería genética sin mutágenos o alteraciones radicales.
Limitaciones e implicaciones éticas del procedimiento
Aun conociendo lo que es y su importancia, se debe decir que la técnica de bloqueo genético no es infalible como muchas fuentes pueden sugerir.
Entre las limitaciones más importantes se encuentran las de carácter técnico, ya que el transporte de las enzimas bloqueadoras no siempre es del todo eficiente. Otro problema que tiene es que las mutaciones insertadas pueden ser naturalmente sustituidas por otras mutaciones mediante procesos espontáneos.
También se debe considerar que seleccionar los genes específicos a modificar no es una actividad sencilla o del todo predecible, por lo que muchas veces no es viable su aplicación en entornos amplios.

¿Por qué la técnica de bloqueo genético se considera penosa a nivel de derechos animales?
La técnica de bloqueo genético se considera penosa a nivel de derechos animales porque tiene efectos inciertos en los sujetos de prueba, lo que provoca que durante años algunas especies sufran mutaciones y experimentación tortuosa con base en un desarrollo innecesario, que puede conseguirse por otras vías.
Técnicas de ingeniería genética: resumen y reflexiones finales
Es importante que las personas conozcan más sobre la ingeniería genética para que esta deje de ser llamada “La ciencia de los transgénicos”, apodo con orígenes en la creencia y recelo popular sobre este campo de estudio, catalogado como una industria de manipulación genética que solo fabrica transgénicos (especies modificadas), cosa que es mentira.
Muchos de los mitos sobre esta ciencia surgen de la ignorancia social y el miedo a lo desconocido por personas que siquiera saben lo que es la manipulación genética realmente.
Por ejemplo, las técnicas de ingeniería genética han permitido la fabricación de insulina, producción de granos, detección de enfermedades degenerativas, fabricar antibióticos y más, todo en grandes cantidades y a precio muy bajos. ¿Si se aceptan estas aplicaciones, por qué no otras?
Es necesario poner sobre la mesa el hecho de que lo que estudia la ingeniería genética va más allá de la simple producción y manipulación de ADN.
Esos sí, si bien se ha convertido en pleno siglo XXI en una herramienta que sostiene al panorama científico y que más influye en la sociedad, a la vez que la escandaliza, es importante preguntarse ¿hasta cuándo o dónde hay que seguir en su estudio y aplicación?
Esto se debe a que es una ciencia cuyos efectos impactan a los bienes sociales de manera directa (vacunas, alimentos, tratamientos médicos…), por lo que los límites éticos deben estar muy bien definidos y vigilados.
En todo caso, se puede afirmar que sin las técnicas de ingeniería genética sería casi imposible sostener hoy día las necesidades alimenticias de la población mundial y la demanda de ciertos productos. Esto no quiere decir, claro, que la manipulación del ADN sea la solución ideal para todos los casos, pero sería cuanto menos insensato no reconocer el potencial que tiene para ayudar a los seres humanos a resolver muchos problemas complejos.

